 Projektträger: ALTHEYS, 42 avenue Julien, 63000 Clermont-Fd, Frankreich
Projektträger: ALTHEYS, 42 avenue Julien, 63000 Clermont-Fd, Frankreich
Dauer der Studie: Januar 2016 bis Dezember 2016
EINFÜHRUNG: :
1.1. Epidemiologie der atopischen Dermatitis
Die Prävalenz der atopischen Dermatitis ist in den vergangenen 30 Jahren von 5–10 % auf 10–25 % gestiegen. Innerhalb des letzten Jahrzehnts haben sich die epidemiologischen Daten vervielfacht und konzentrieren sich nicht länger nur auf atopische Manifestationen der Atemwege. Die meisten Autoren führen diesen Anstieg auf Umweltveränderungen in der frühen Kindheit zurück. Eine atopische Dermatitis (häufig als Ekzem bezeichnet) ist eine chronische, juckende Entzündung der oberen Hautschichten, die in Schüben verläuft. Die genetische Forschung konnte ein wichtiges kausales Element für die atopische Dermatitis isolieren und hebt die Barriere der kutanen Permeabilität als zentralen Bestandteil der Pathophysiologie hervor. Die zahlreichen in den veröffentlichten Studien für die Schübe genannten Ursachen lassen sich jedoch nur unzureichend bestätigen. Bestimmte Ursachen, darunter die Außentemperatur, Reizstoffe und Aeroallergene, ziehen epidemiologisch bzw. experimentell nachgewiesene Auswirkungen auf diese Barriereanomalie nach sich.
1.2. Behandlung der atopischen Dermatitis
Ziel der Behandlung ist es, die Symptome so weit wie möglich zu lindern und Ekzemausbrüche langfristig zu unterbinden. Erst wenn die Entzündung / das Ekzem abgeheilt ist, kann die epidermale Barriere mit einfachen feuchtigkeitsspendenden Produkten optimal intakt gehalten werden. Die meisten Behandlungen beruhen auf den folgenden Prinzipien:
- Regeneration der epidermalen Barriere durch ein geeignetes topisches Produkt (Hautreinigung und aufbauende Pflege)
- Prophylaxe und Behandlung von Hautinfektionen durch regelmäßige Hautreinigung und topische entzündungshemmende Behandlungen (Antiseptika, ggf. Antibiotika und Kortikosteroide)
- Entzündungshemmende Behandlungen zur schnellen Heilung der Ekzemausbrüche und Verhinderung eines Wiederauftretens
- Die für eine Behandlung unerlässliche Wiederherstellung der epidermalen Barriere erfolgt mit nicht medikamentösen Emollient-Produkten, deren Rezeptur Feuchtigkeitsspender und Lipide enthält, die wiederum als Ersatz für die beeinträchtigte Talgsekretion dienen.
1.3. Bewertung der atopischen Dermatitis
SCORAD (Scoring atopic dermatitis) ist ein klinisches Bewertungssystem, das zur möglichst objektiven Bestimmung des Schweregrads der atopischen Dermatitis genutzt wird. Es wurde 1990 von der European Task Force of Atopic Dermatitis entwickelt und validiert und hat sich seitdem zur Referenz für die Bewertung und Behandlung der Pathologie durch Ärzte in ganz Europa entwickelt. SCORAD ist in Form eines Papierformulars oder digitalen Fragebogens verfügbar und wird im Rahmen der Untersuchung durch den Arzt ausgefüllt. Der daraus entstehende Score erlaubt, die Entwicklung der atopischen Dermatitis beim Patienten zu verfolgen.
2. ART DER KOHORTENSTUDIE
Diese nicht-interventionelle Längsschnittstudie folgt Patienten mit atopischer Dermatitis anhand der Entwicklung ihres SCORAD-Scores während der Anwendung der Körpercreme Zematopic® Ekzem und erfasst deren Verträglichkeit.
Die Körpercreme Zematopic® Ekzem hat den rechtlichen Status eines Medizinprodukts und ist daher kein Arzneimittel. Diese Beobachtungsstudie wurde im Rahmen der herkömmlichen ärztlichen Verfahrensweise durchgeführt und erforderte keine zusätzlichen diagnostischen oder therapeutischen Maßnahmen.
Es handelt sich um eine nicht-interventionelle Studie.
3. ZIELE DER STUDIE
Einmonatige Beobachtung einer Patientenkohorte mit atopischer Dermatitis, die eine zusätzliche Behandlung mit der Körpercreme Zematopic® Ekzem erhält. Primäres Ziel der Studie war die Bewertung der Entwicklung der Patienten gemäß des SCORAD-Scores.
Zu den sekundären Zielen der Studie zählen:
- Bewertung der Verträglichkeit der Körpercreme Zematopic® Ekzem während dieser Studie, ALTHEYS-Kohortenstudie Seite 2 bis 23
4. GESETZLICHE BESTIMMUNGEN
4.1. Aktuelle Fassung des französischen Gesetzes vom 6. Januar 1978 über Datenverarbeitung, Dateien und individuelle Freiheiten
Die Erhebung der Patientendaten erfolgte indirekt nominell. Auf den Studiendokumenten wurde kein Patientenname angegeben, der einzige Code für die Durchführung der Eingabekontrolle entsprach der Teilnahmenummer.
Die im Rahmen dieser Beobachtungsstudie durchgeführte computergestützte Verarbeitung der Patientendaten und ärztlichen Dokumente wurde nach Stellungnahme des französischen Beratungsausschusses für die Behandlung von Daten im Bereich der Gesundheitsforschung (Comité Consultatif sur le Traitement de l'Information en Matière de Recherche dans le Domaine de la Santé – CCTIRS) von der nationalen Datenschutzbehörde Frankreichs (Commission Nationale de l’Informatique et des Libertés – CNIL) genehmigt.
4.2. Schutz der Studienteilnehmer
Im Rahmen dieser Studie wurden keine Richtlinien für die Patientenbehandlung festgelegt. Die Studie hat das Arzt-Patienten-Verhältnis nicht verändert und fällt daher nicht unter das französische Gesetz über die biomedizinische Forschung (Gesetz 88–1138 vom 20. Dezember 1988 in seiner geänderten Fassung). Entsprechend wurde von den Patienten keine schriftliche Einwilligung eingeholt und eine vorherige Stellungnahme durch eine Leitstelle war nicht erforderlich. Jedem teilnehmenden Patienten wurde ein einfaches Informationsschreiben ausgehändigt.
5. VERLAUF DER BEOBACHTUNGSSTUDIE
Diese Beobachtungsstudie wurde von Januar bis Dezember 2016 in Frankreich durchgeführt.
5.1. Vorbereitung der Beobachtungsstudie
Im Rahmen der Vorbereitung dieser Studie wurde jedem teilnehmenden Arzt ein Startpaket ausgehändigt. Dieses bestand aus den folgenden Elementen:
- Teilnahmeformulare für die Verlaufskontrolle und Entlassung der Patienten
- Studienprotokoll
- Leitfaden für die Berechnung des SCORAD-Scores- Administrative Elemente
- administrative elements.
Im Rahmen der ersten Untersuchung informierte der Arzt den Patienten über die Durchführung der Beobachtungsstudie. Bei Zustimmung wurde das Teilnahmeformular durch den Arzt ausgefüllt, der Patient erhielt ein Informationsschreiben zu der Beobachtungsstudie.
5.2. Verlaufskontrolle
Der Arzt behandelte Patienten gemäß seiner herkömmlichen Verfahrensweise.
Am Ende jeder Untersuchung füllte der Arzt ein Formular zur Verlaufskontrolle mit den klinischen Daten sowie dem SCORAD-Score aus.
5.3. Ende der Beobachtungsstudie
Die Beobachtung verlief über durchschnittlich 29 Tage.
Am Ende der etwa vierwöchigen Verlaufskontrolle vervollständigte der Arzt die Formulare für die Verlaufskontrolle und Entlassung der Patienten.
5.4. Monitoring der Beobachtungsstudie
- Das zentralisierte telefonische Monitoring wurde von ALTHEYS durchgeführt
- Begleitung der Ärzte: Beantwortung aufkommender Fragen, logistisches Follow-up und regelmäßiges Ausfüllen und Zurücksenden der Dokumente nach dem zuvor festgelegten Zeitplan sowie Nachverfolgung medizinischer Anfragen zu unvollständigen Daten
- Vor-Ort-Besuch bei allen teilnehmenden Ärzten im Rahmen der Vorbereitung der Beobachtungsstudie
Des Weiteren stand den teilnehmenden Ärzten während der gesamten Beobachtungsstudie eine von ALTHEYS eingerichtete Hotline zur Verfügung, um Anfragen zur Durchführung und zum Ablauf der Studie zu beantworten.
Die Patientendaten wurden über Formulare zur Teilnahme, Verlaufskontrolle und Entlassung als nicht-identifizierende Daten gesammelt.
6. MATERIAL AND METHODS
6. MATERIAL UND METHODEN
6.1. Protokoll
6.1.1. Teilnehmende Ärzte
31 general practitioners and liberal specialists participated in this observatory.
6.1.2. Ausgewählte Patienten
Die ausgewählten Patienten waren Bestandspatienten der teilnehmenden Ärzte. Sie wurden in der Reihenfolge ihres Eintreffens zur Untersuchung in die Beobachtungsstudie aufgenommen.
6.1.3. Kriterien für die Teilnahme von Patienten
- Patienten mit atopischer Dermatitis, für die der Arzt die Anwendung der Körpercreme Zematopic® Ekzem als mögliche Behandlung vorgesehen hatte.
6.1.4. Kriterien für die Nichtteilnahme von Patienten
- Patienten mit begleitenden dermatologischen Erkrankungen.
- Patienten, die bereits an einer biomedizinischen Forschung teilnahmen oder im Vormonat teilgenommen hatten.
- Patienten mit einer Allergie gegen einen der Inhaltsstoffe des Arzneimittels
- Patienten, die keine Teilnahme an der Studie wünschten
6.1.5. Erfasste Daten
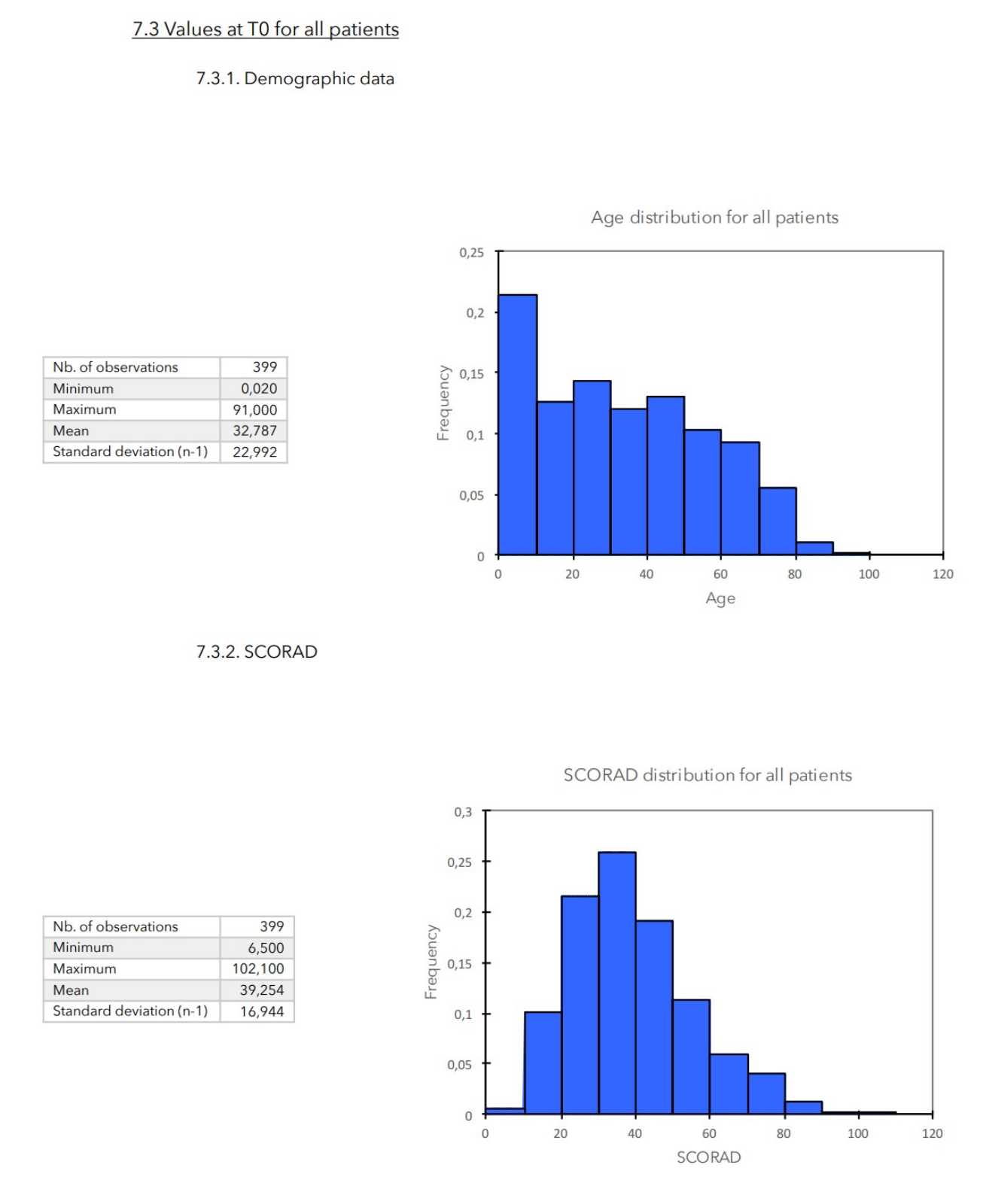
T0: - Allgemeine klinische Patientendaten (Alter, Gewicht, Geschlecht)
- Daten über eventuell durchgeführte medizinische Behandlungen
- Berechnung des SCORAD-Scores
-- Anwendung der Körpercreme Zematopic® Ekzem und Erfassung der Bewertung des Patienten oder eines Angehörigen (bei Kindern) (Punktzahl 1 bis 10).
T1 = about four weeks:
T1 = ca. vier Wochen:
- Berechnung des SCORAD-Scores
- Fortgesetzte Anwendung von Körpercreme Zematopic® Ekzem seit der vorherigen Untersuchung: fortwährend oder unterbrochen, Erfassung der Gründe.
- Verträglichkeit: Nebenwirkungen (Anzahl, Art, Schweregrad etc.).
6.2. Verwendetes Produkt
Bei dem für die Studie verwendeten Produkt handelte es sich um die in Apotheken erhältliche Körpercreme Zematopic® Ekzem: Medizinprodukt in weißen „Airless“-Pumpflaschen à 200 ml.
6.3. Statistik
6.3.1. Variablen
- Als Ausreißer werden alle Daten bezeichnet, die außerhalb der vorgesehenen Grenzen der Datenverteilung liegen (Interquartilsabstand). Ausreißer wurden nach Klärung mit dem betreffenden Arzt in die statistischen Berechnungen einbezogen, sofern sie nicht auf einen offensichtlichen Fehler zurückzuführen waren.
6.3.4. Statistische Analyse und Auswertung der Ergebnisse- Für quantitative Variablen durch die Mittelwerte plus/minus einer Standardabweichung, die Mediane sowie die Extremwerte, nach Überprüfung ihrer normalen Verteilung
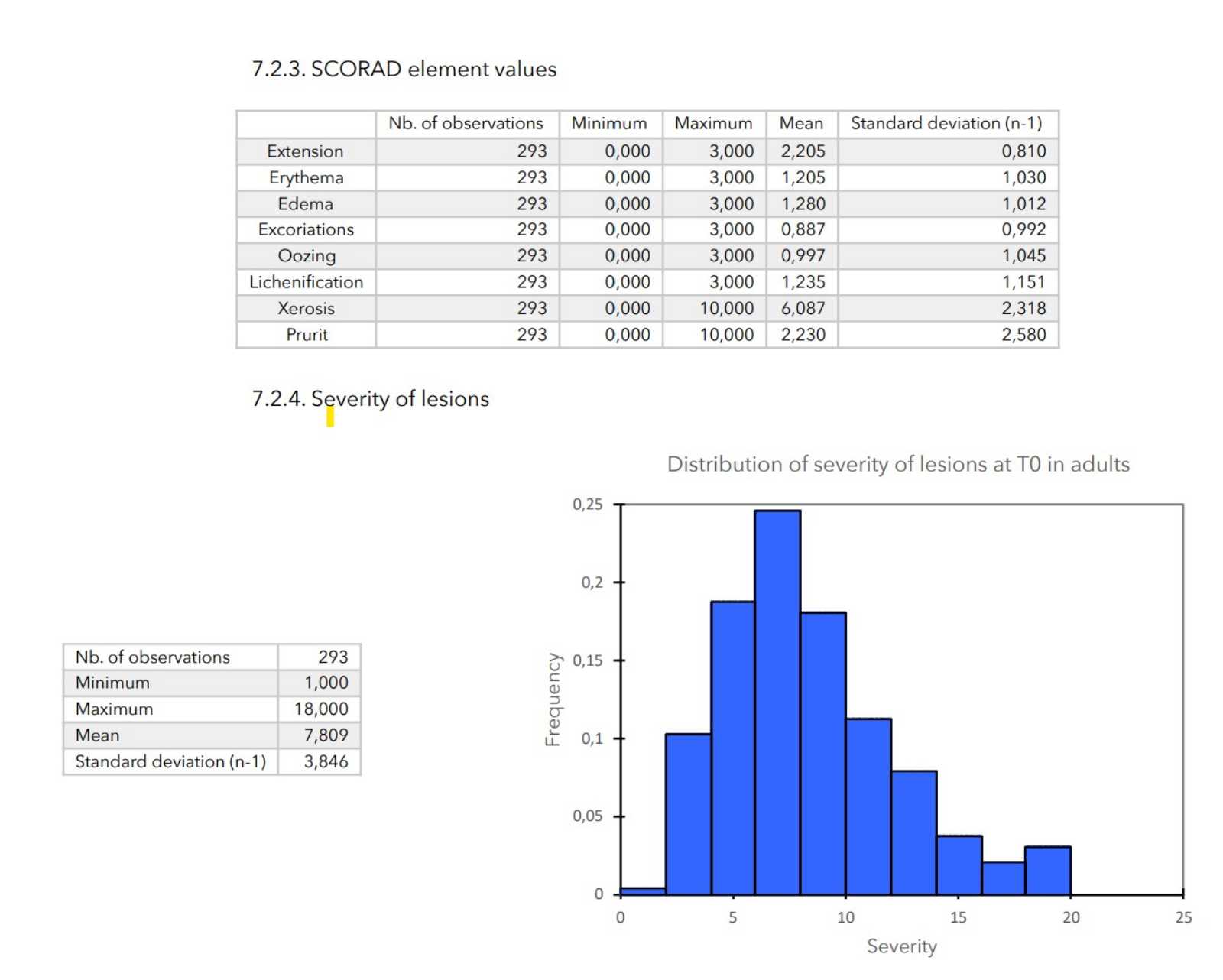
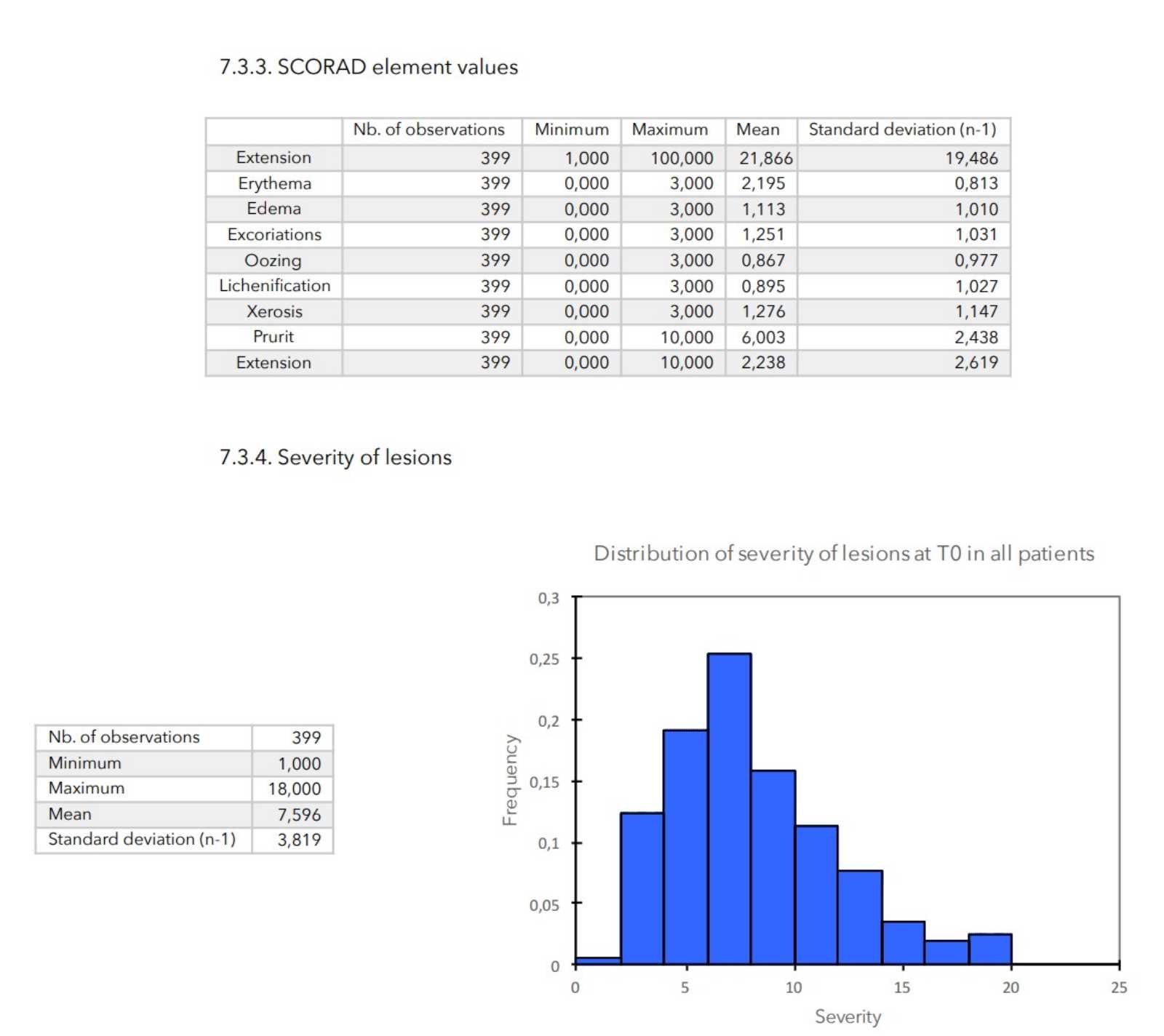
- Die SCORAD-Berechnung erfolgt wie folgt:
SCORAD = (Umfang / 5) + (7 (Schweregrad / 2) + Sondierung.
- Schweregrad der Läsionen: Berechnet als Summe aller Scores für die Hautbewertung.
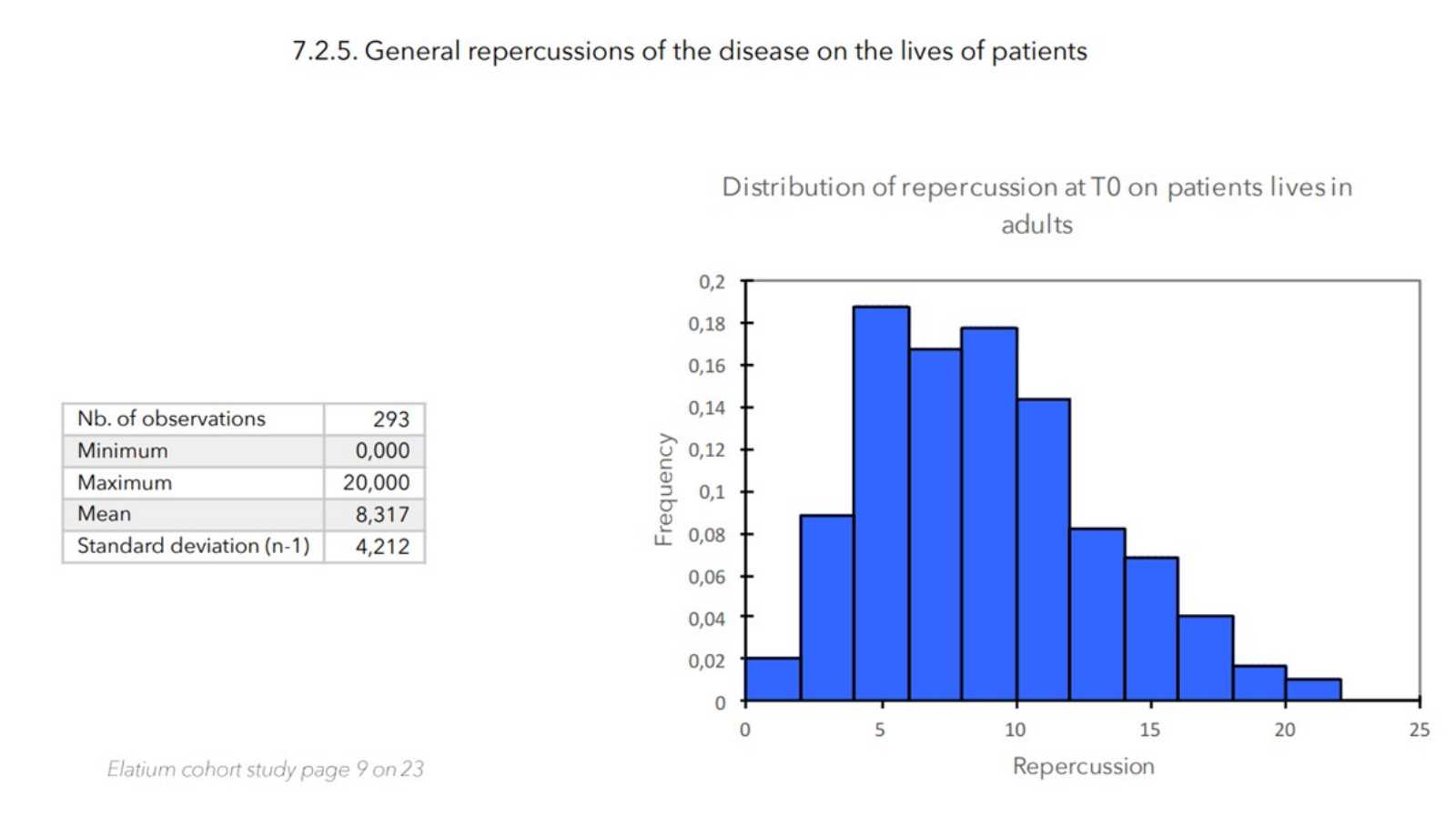
- Wert der allgemeinen Auswirkung der Krankheit auf das Leben des Patienten:
- Score für Pruritus + Score für Schlaflosigkeit
- Nebenwirkungen (Häufigkeit, Art, Kausalität und Schweregrad)
7. ZU BEGINN DER STUDIE GEMESSENE WERTE
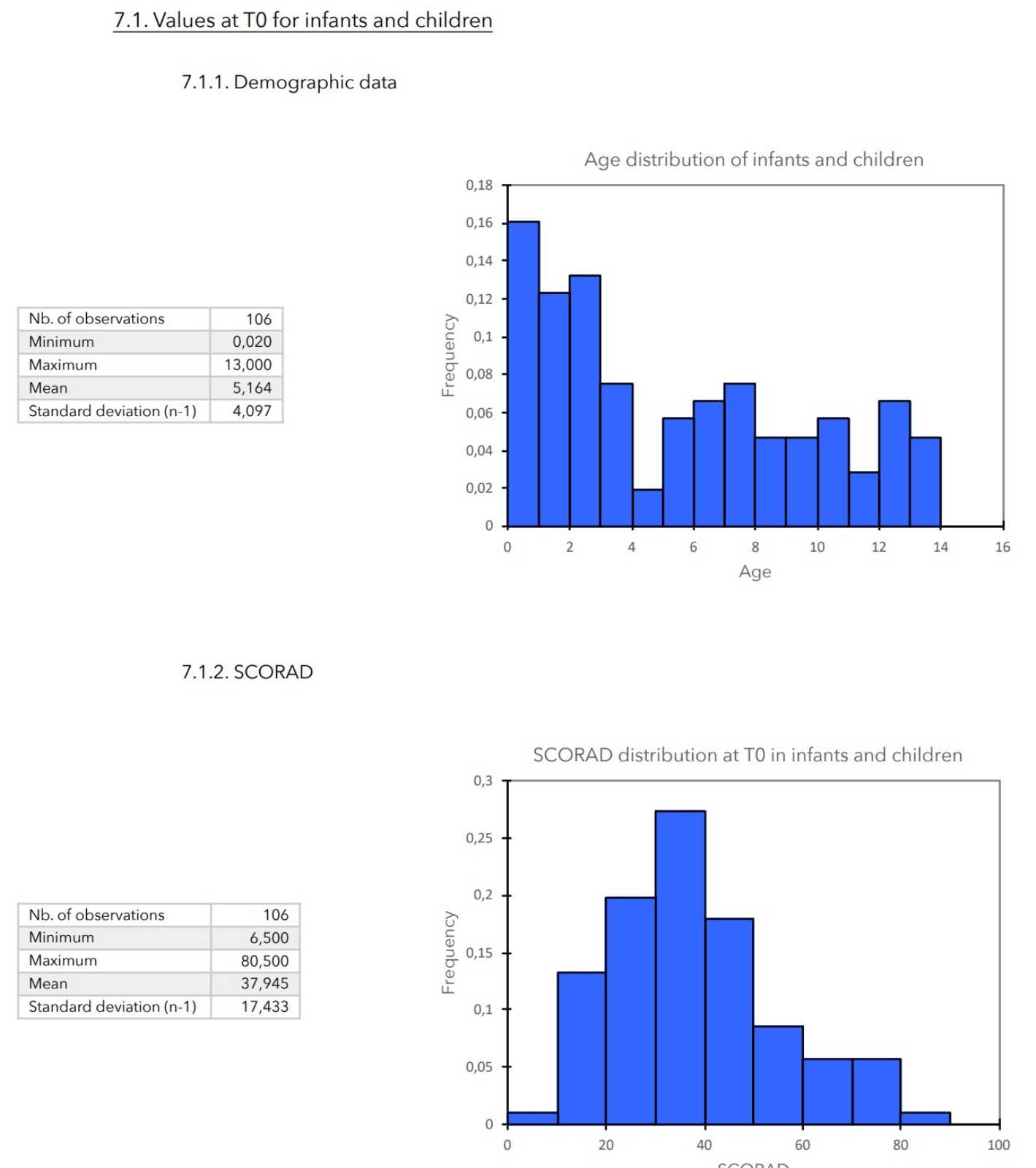
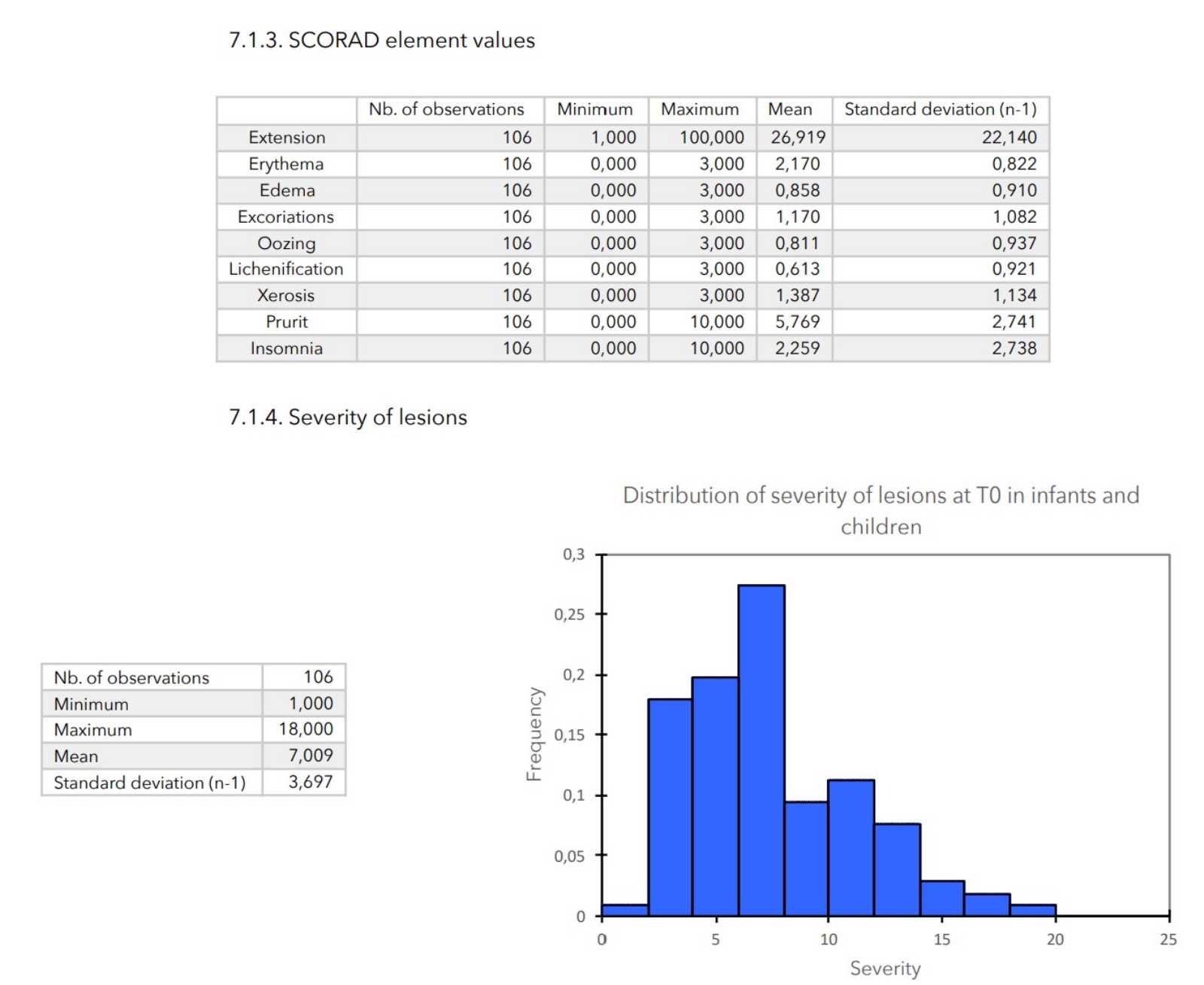
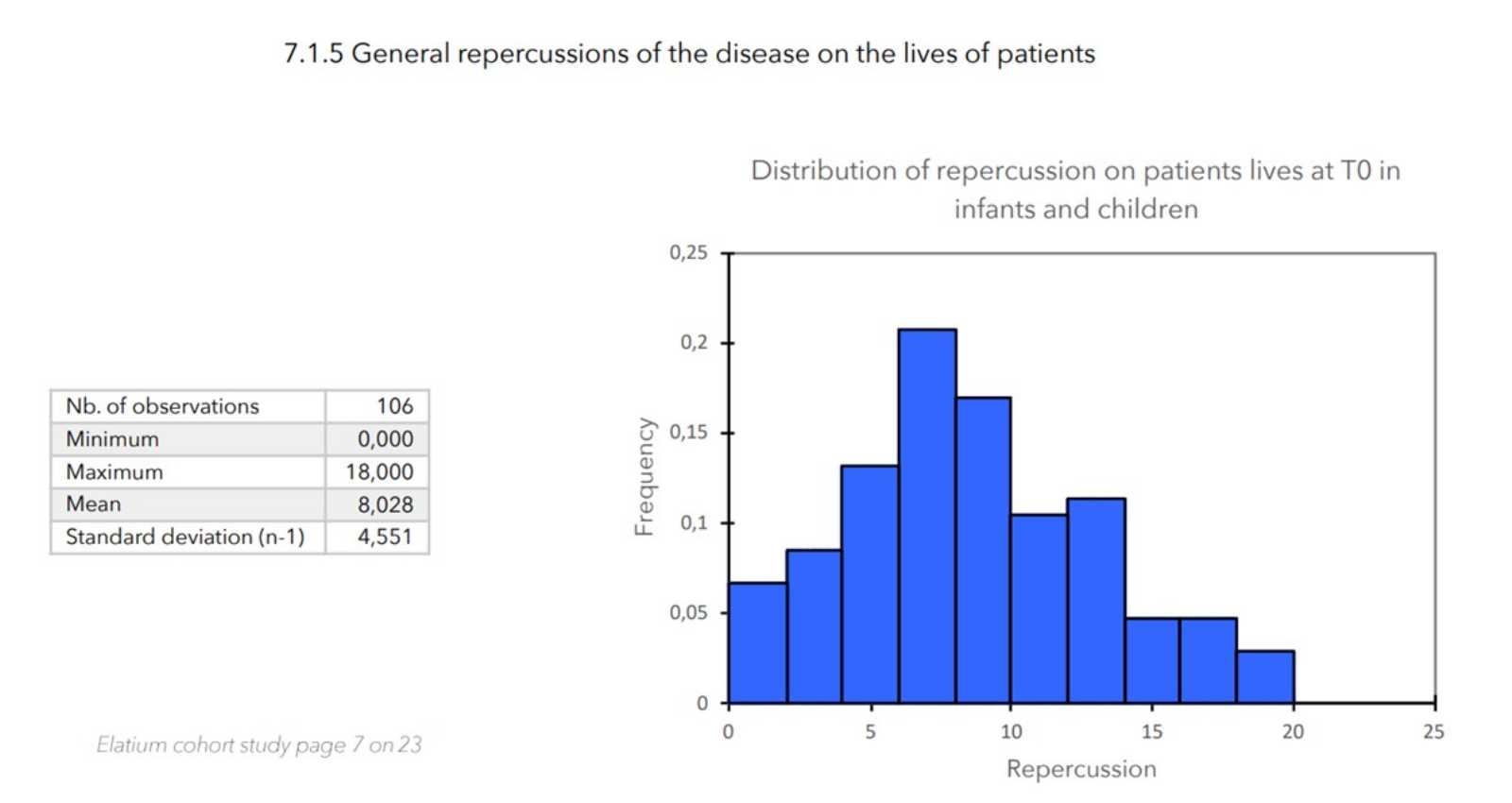
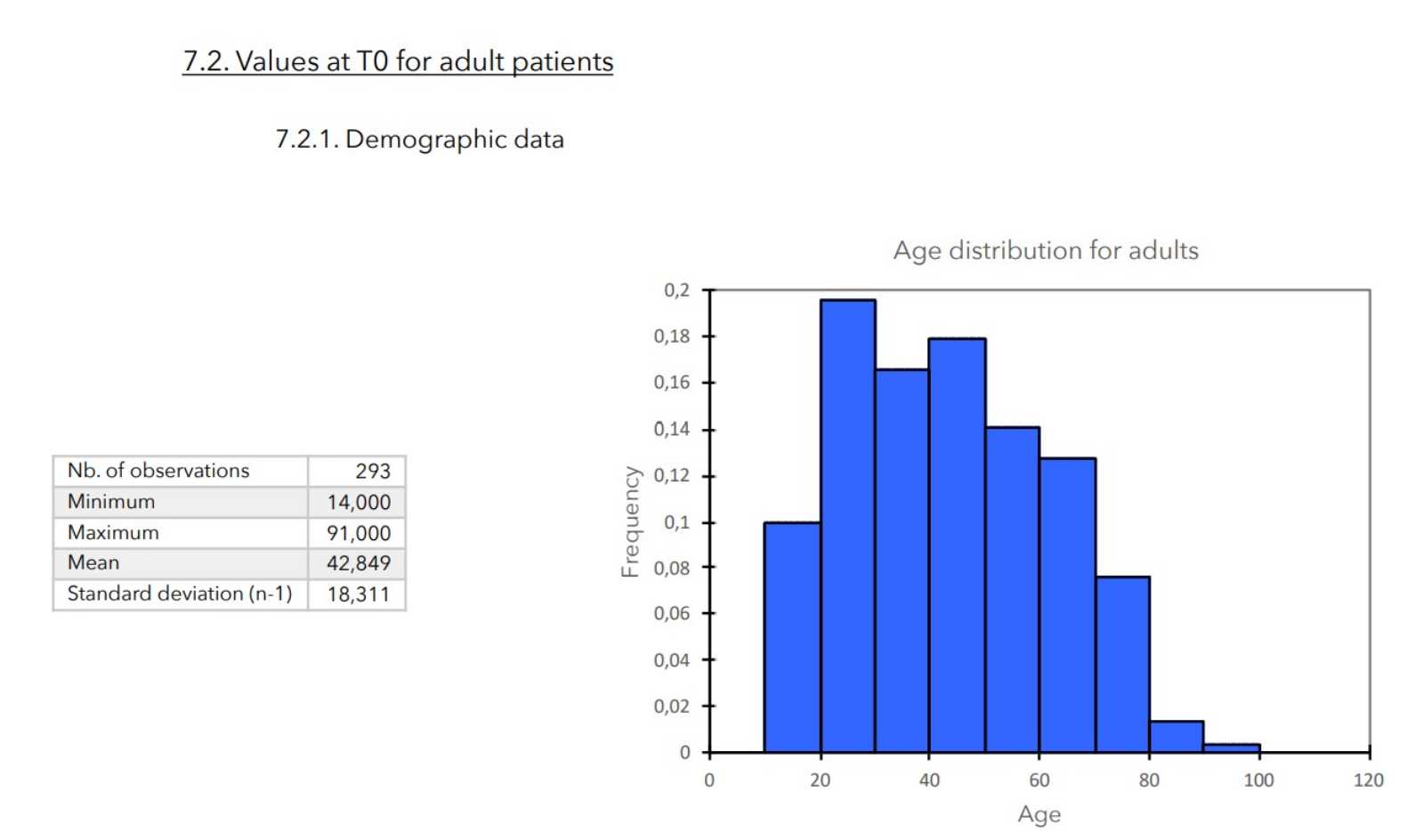
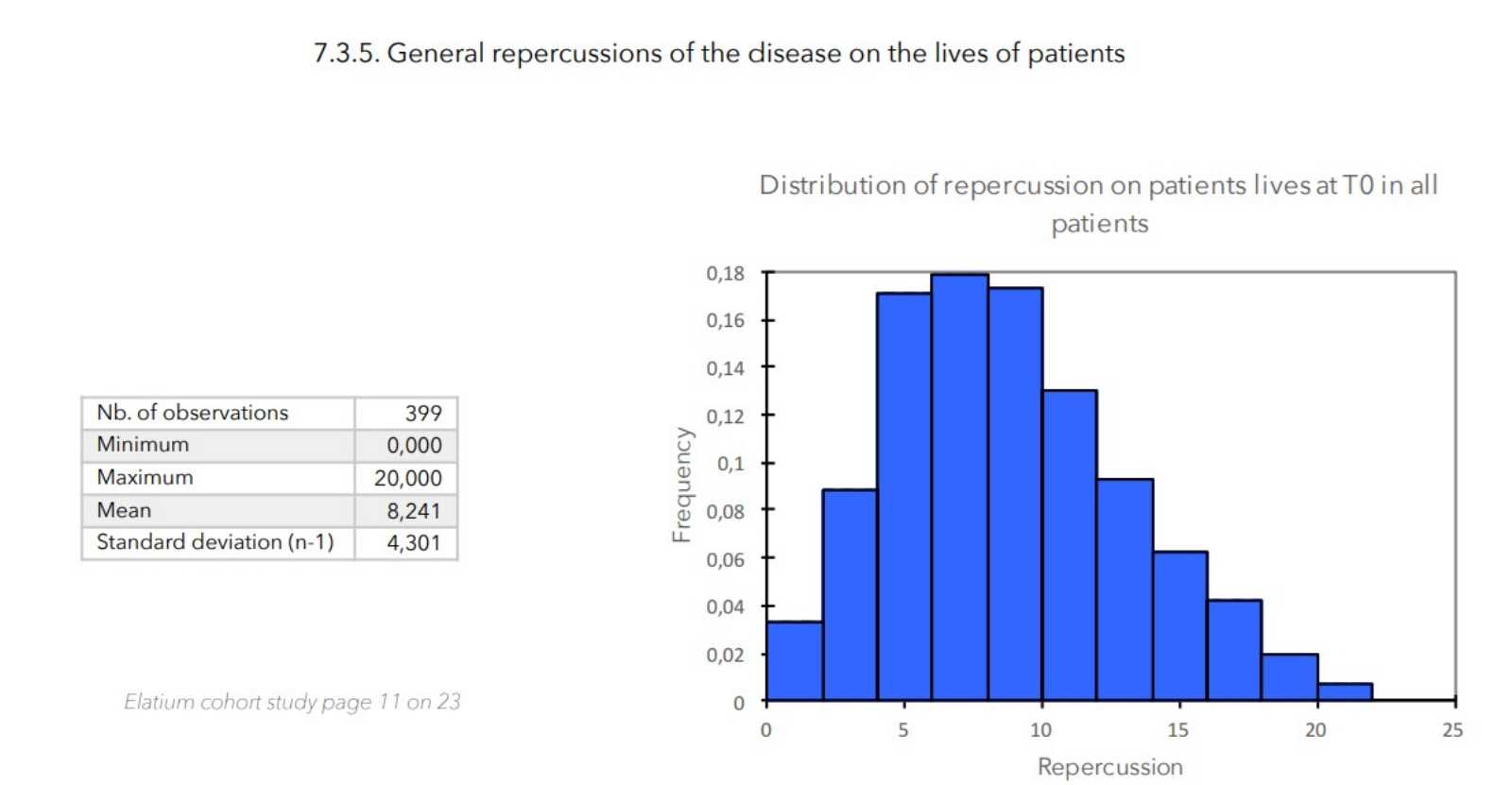
ERGEBNISSE
8.1. Nebenwirkungen
Im Verlauf der Studie wurden keine nennenswerten Nebenwirkungen festgestellt.
Bei der Anwendung der Creme traten die folgenden Empfindungen auf:
- 2 kribbelnde Wahrnehmungen
- 1 brennendes Empfinden
- 1 juckendes Gefühl
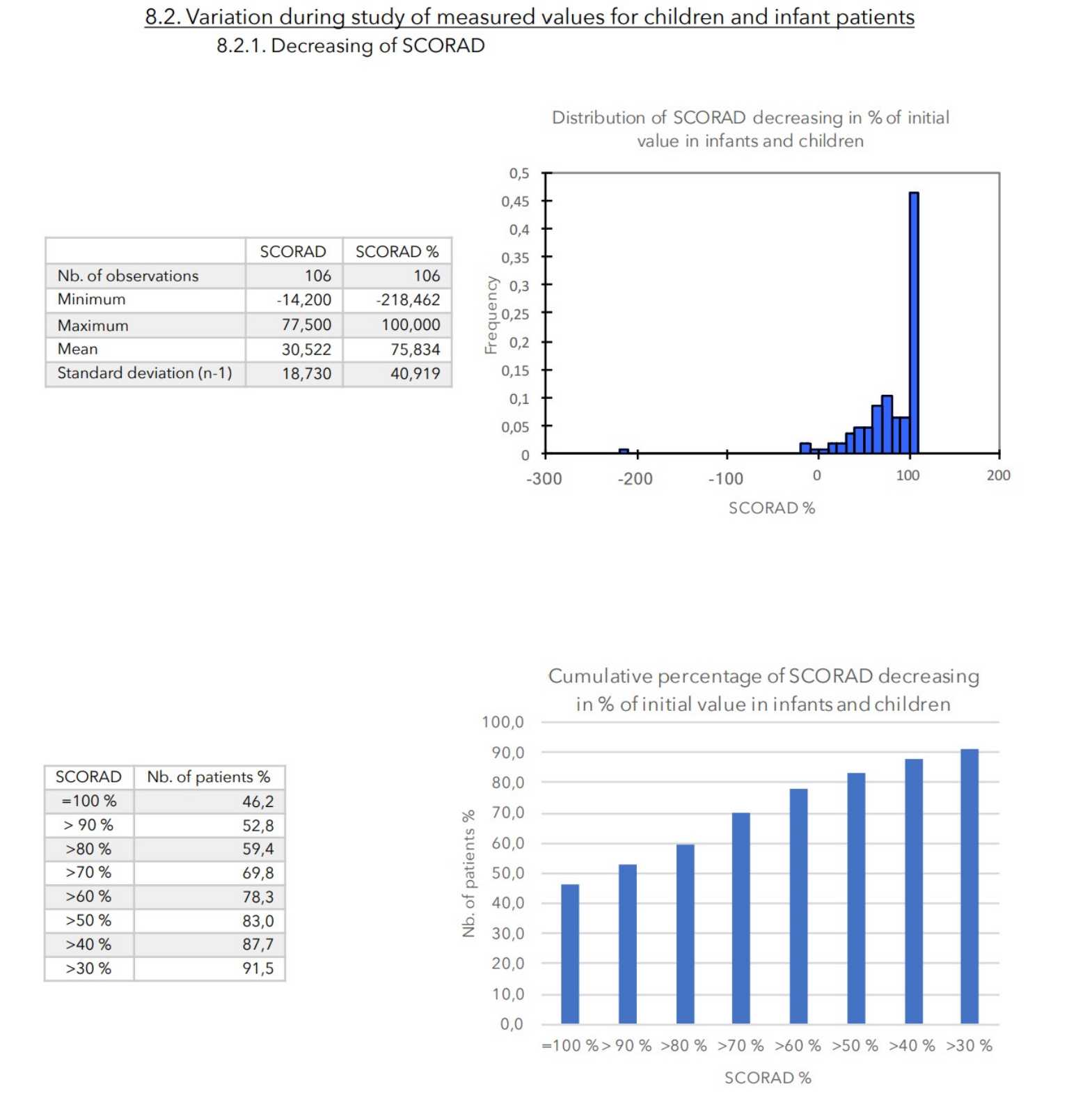
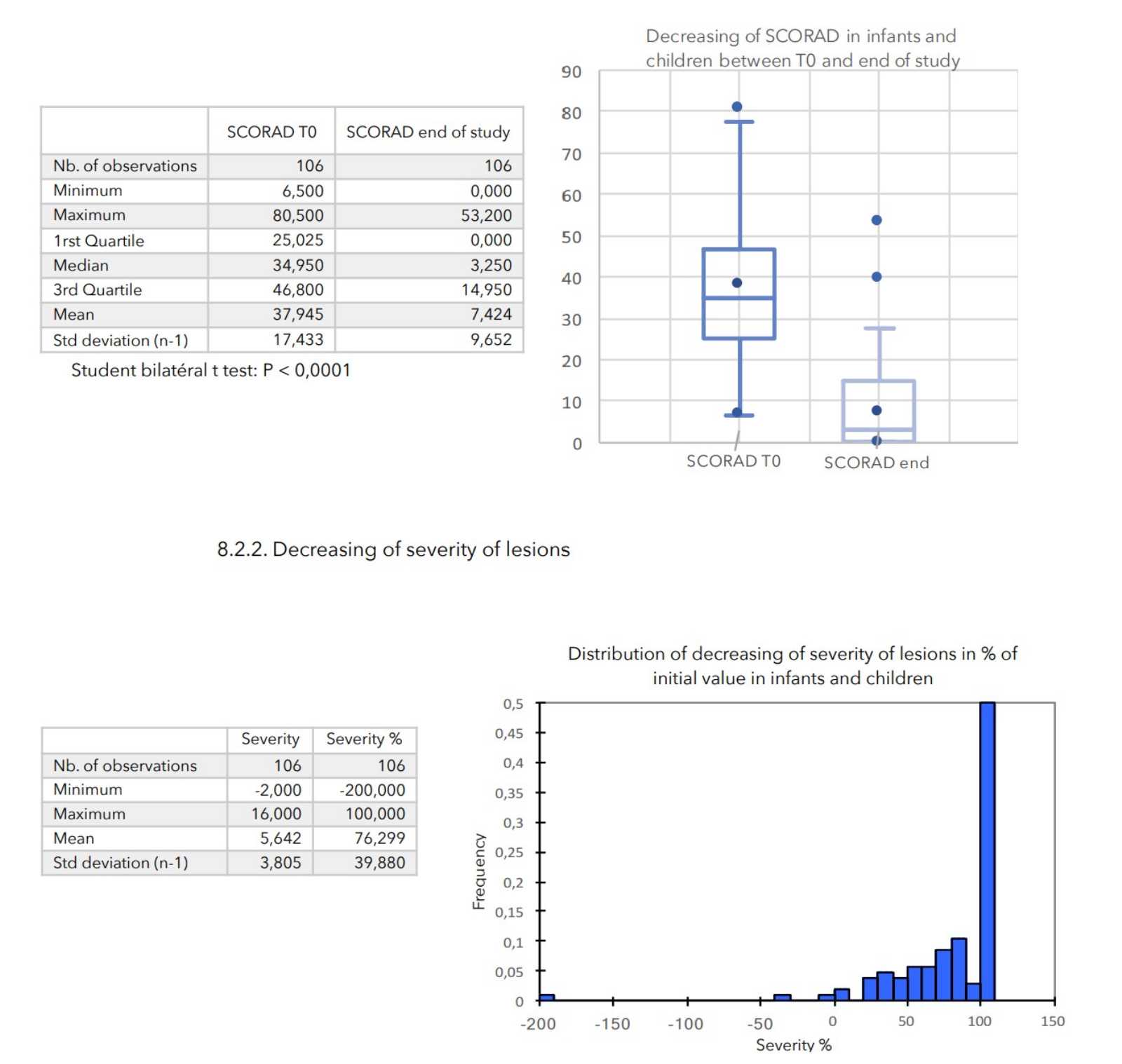
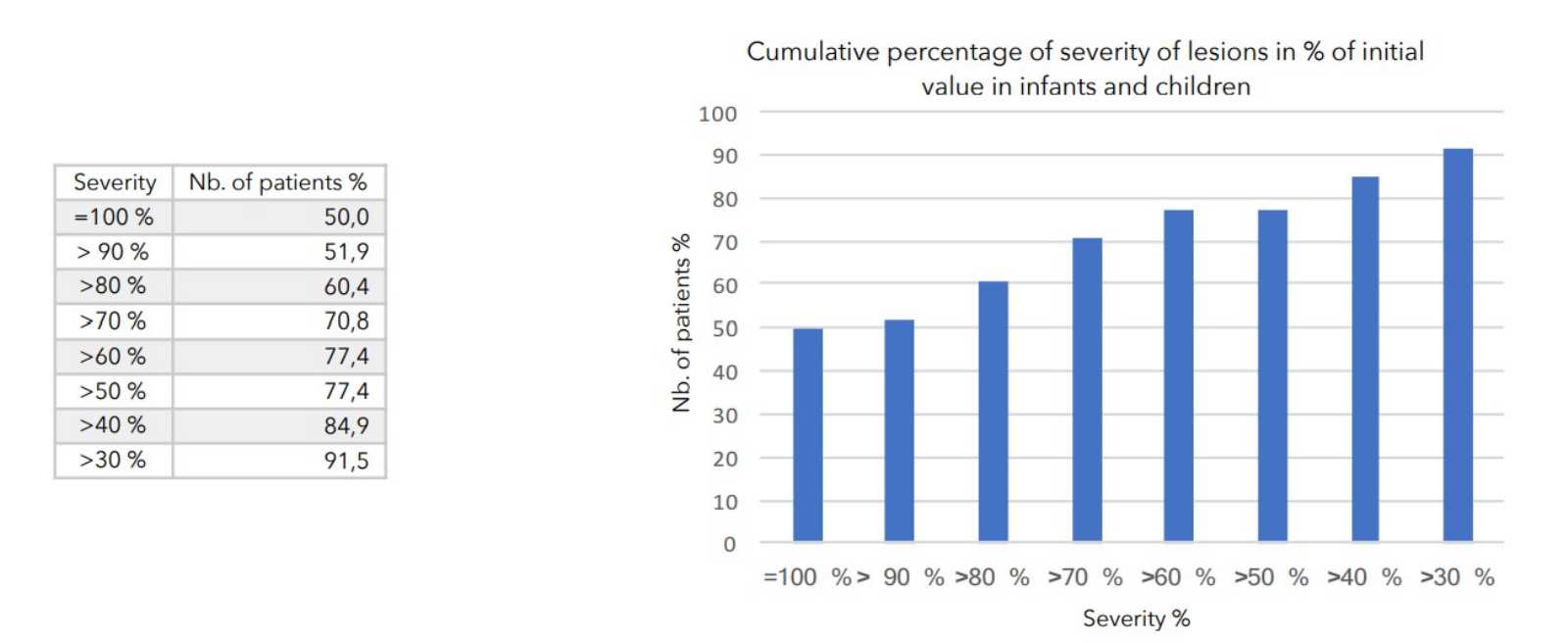
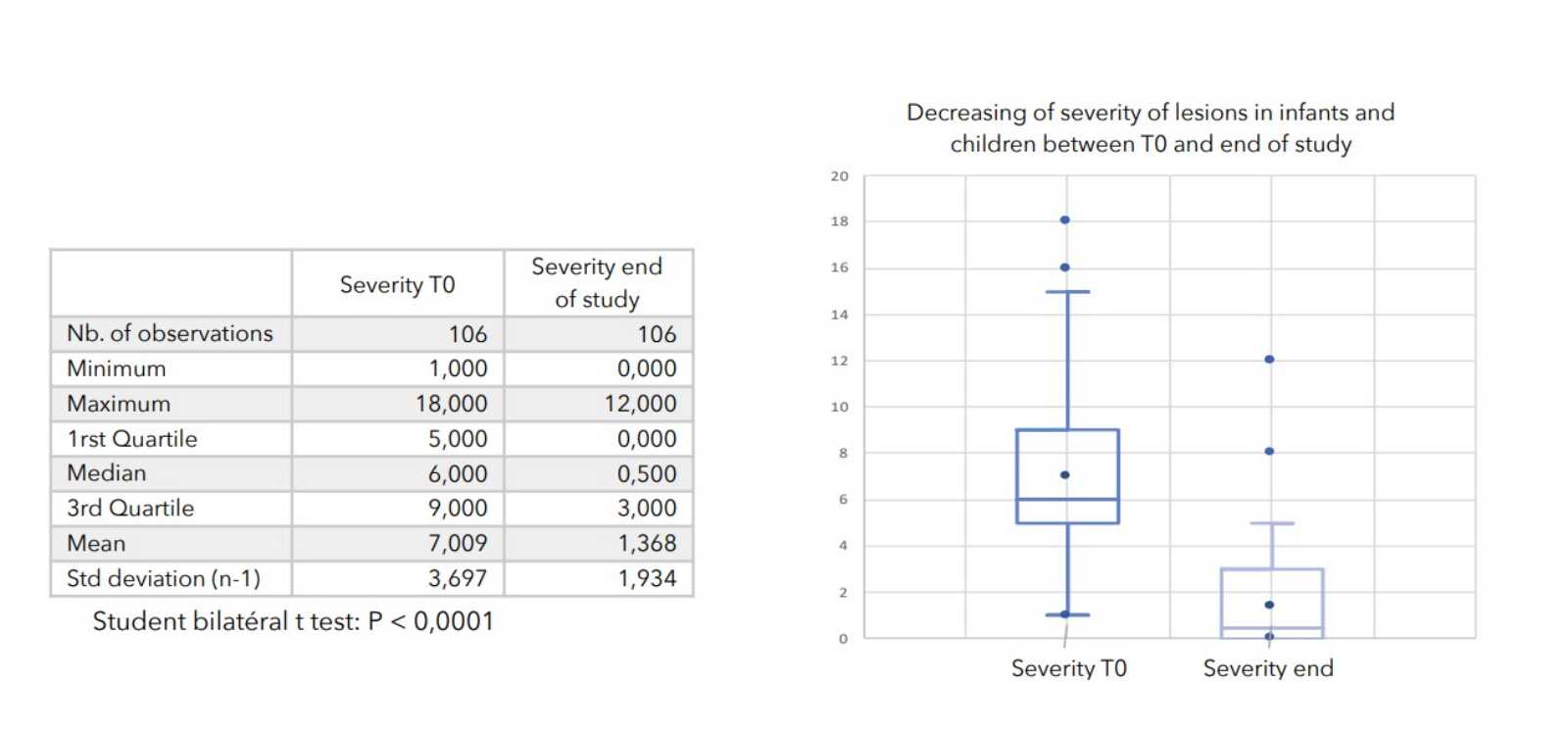
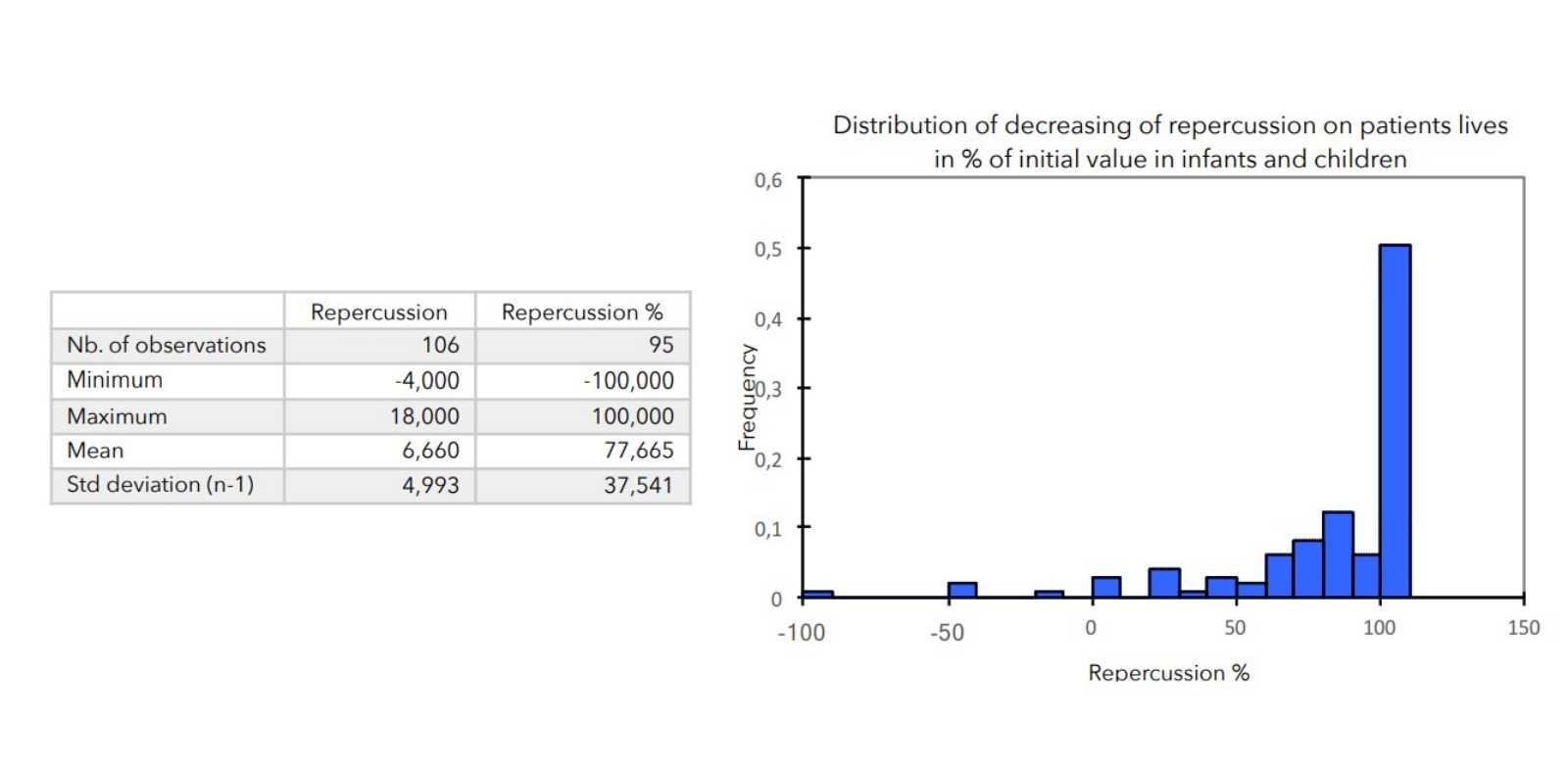
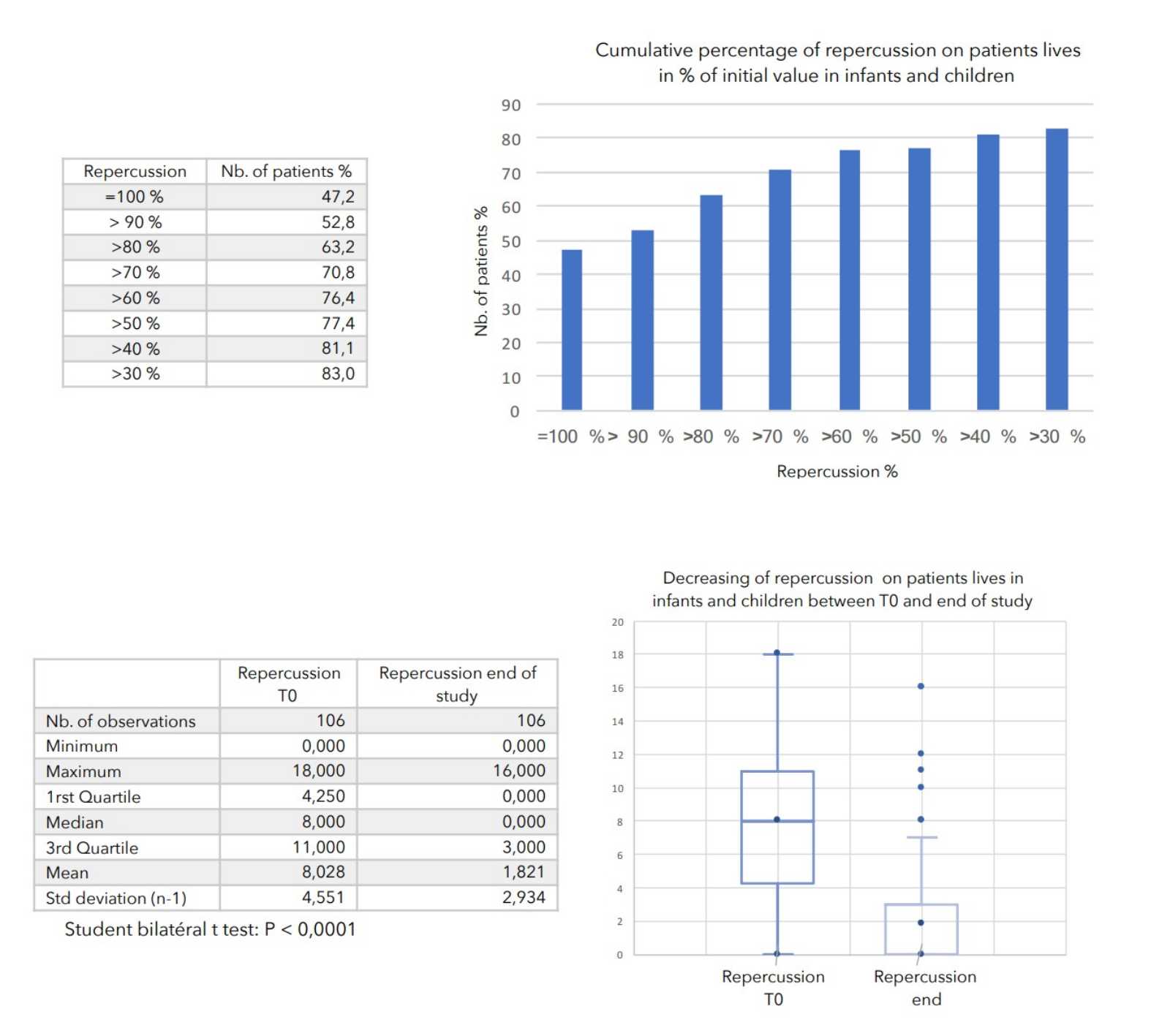
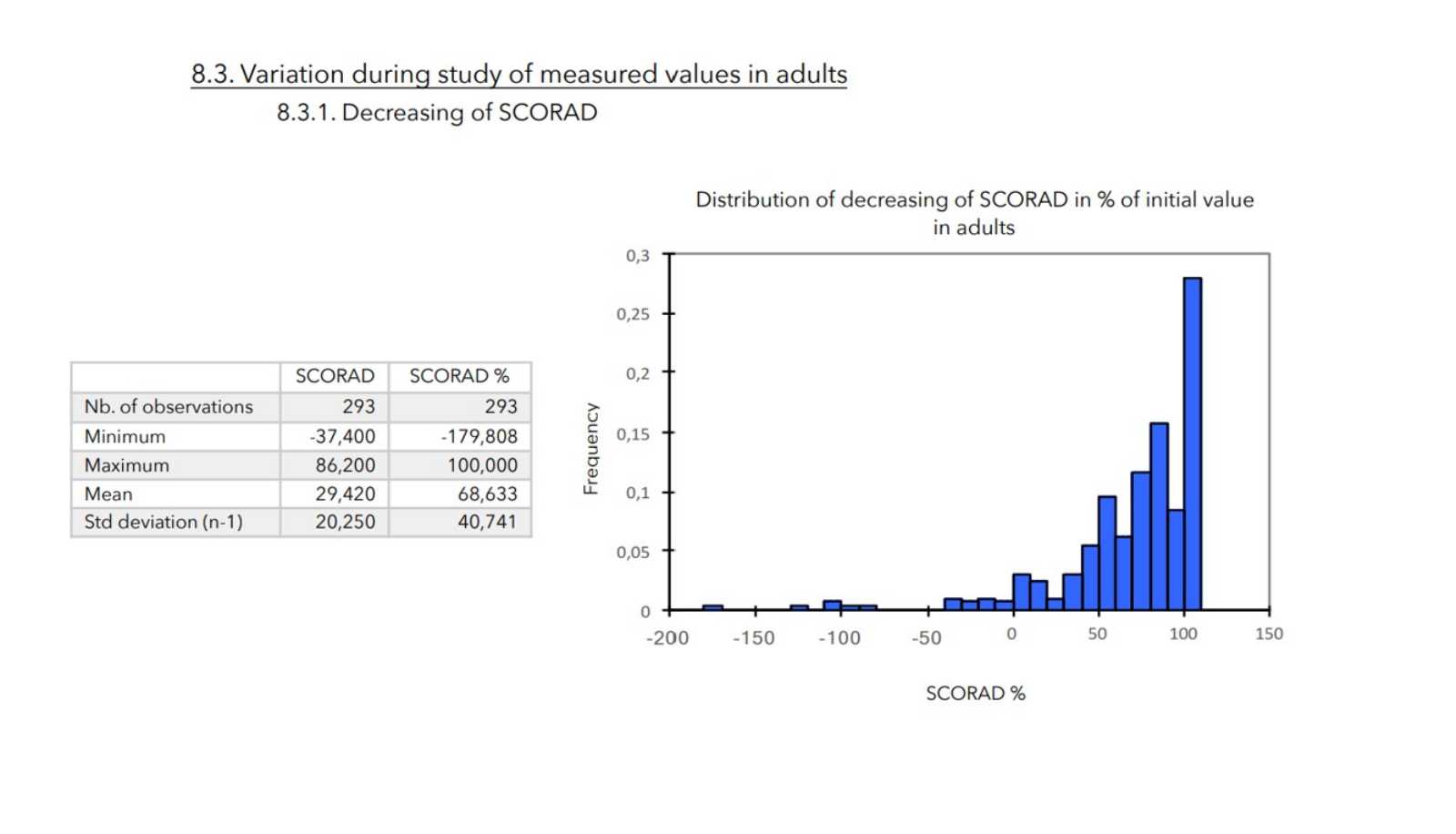

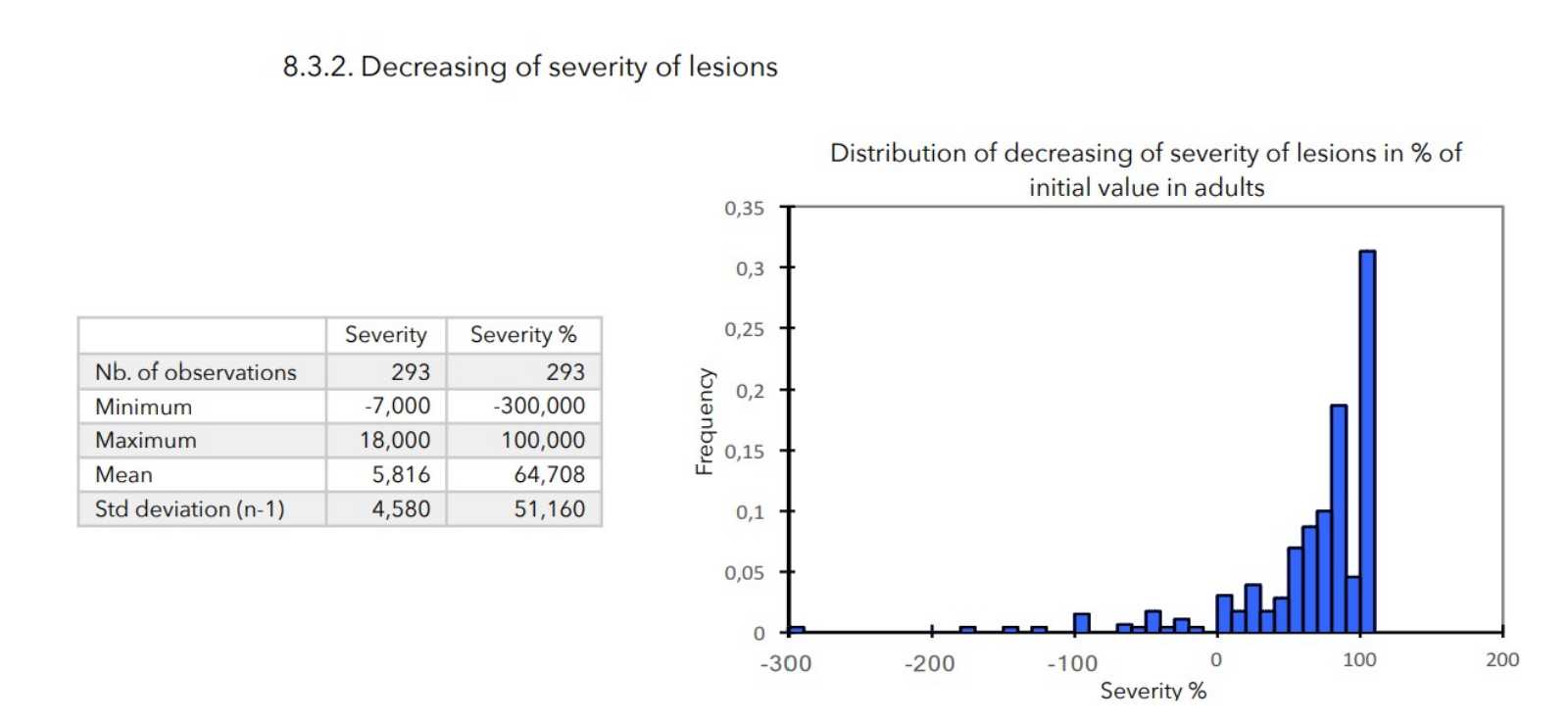
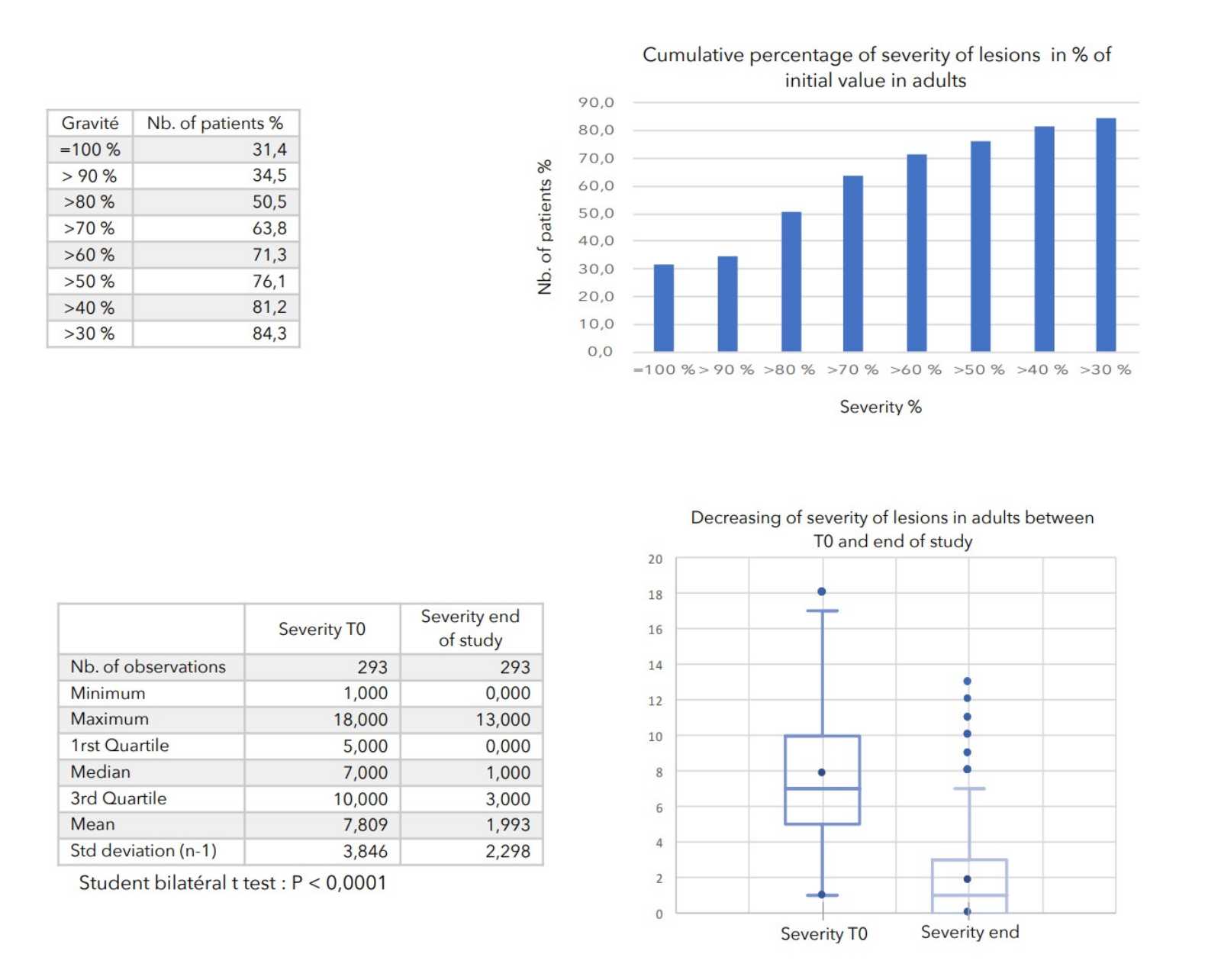
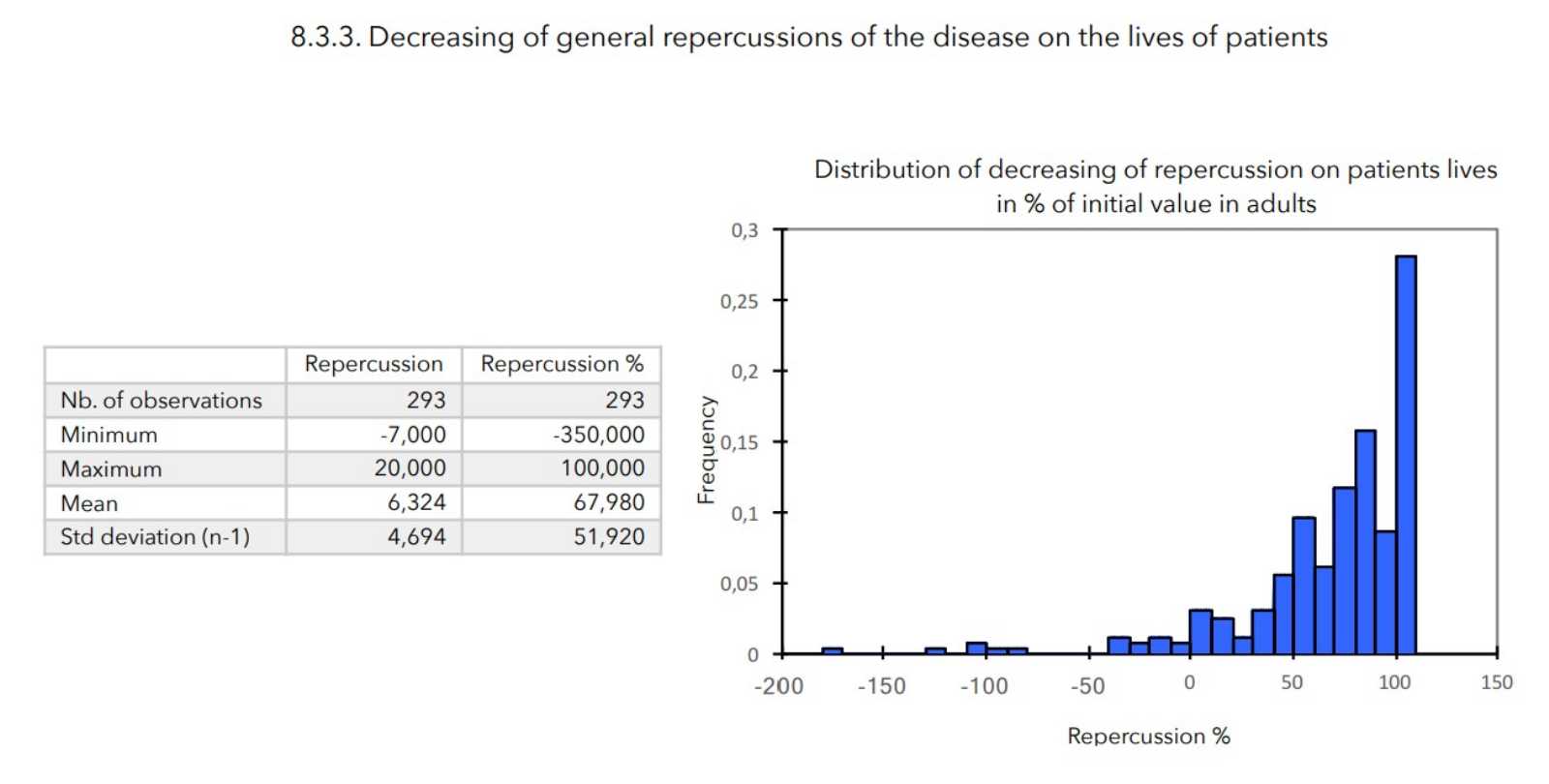
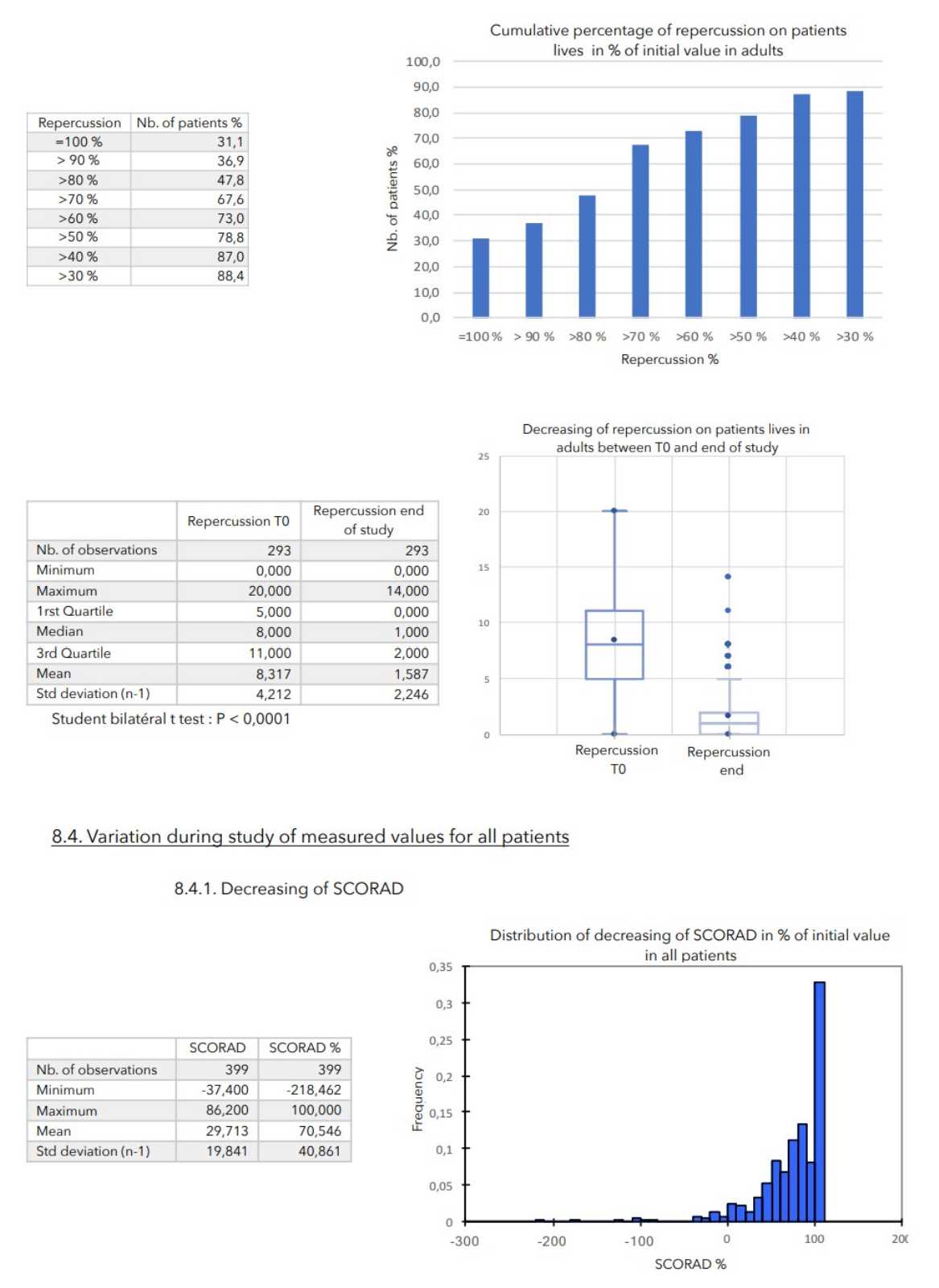
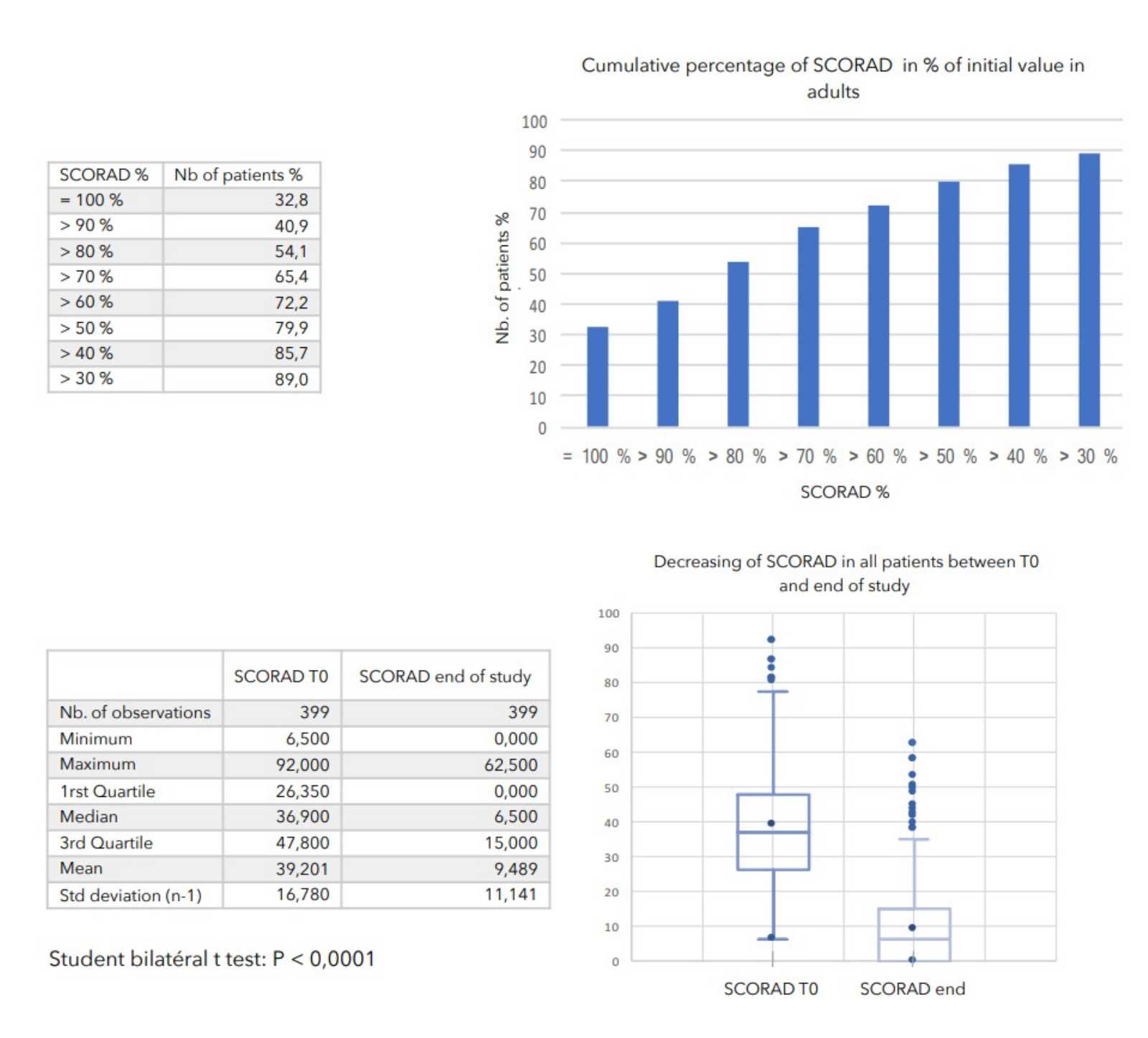
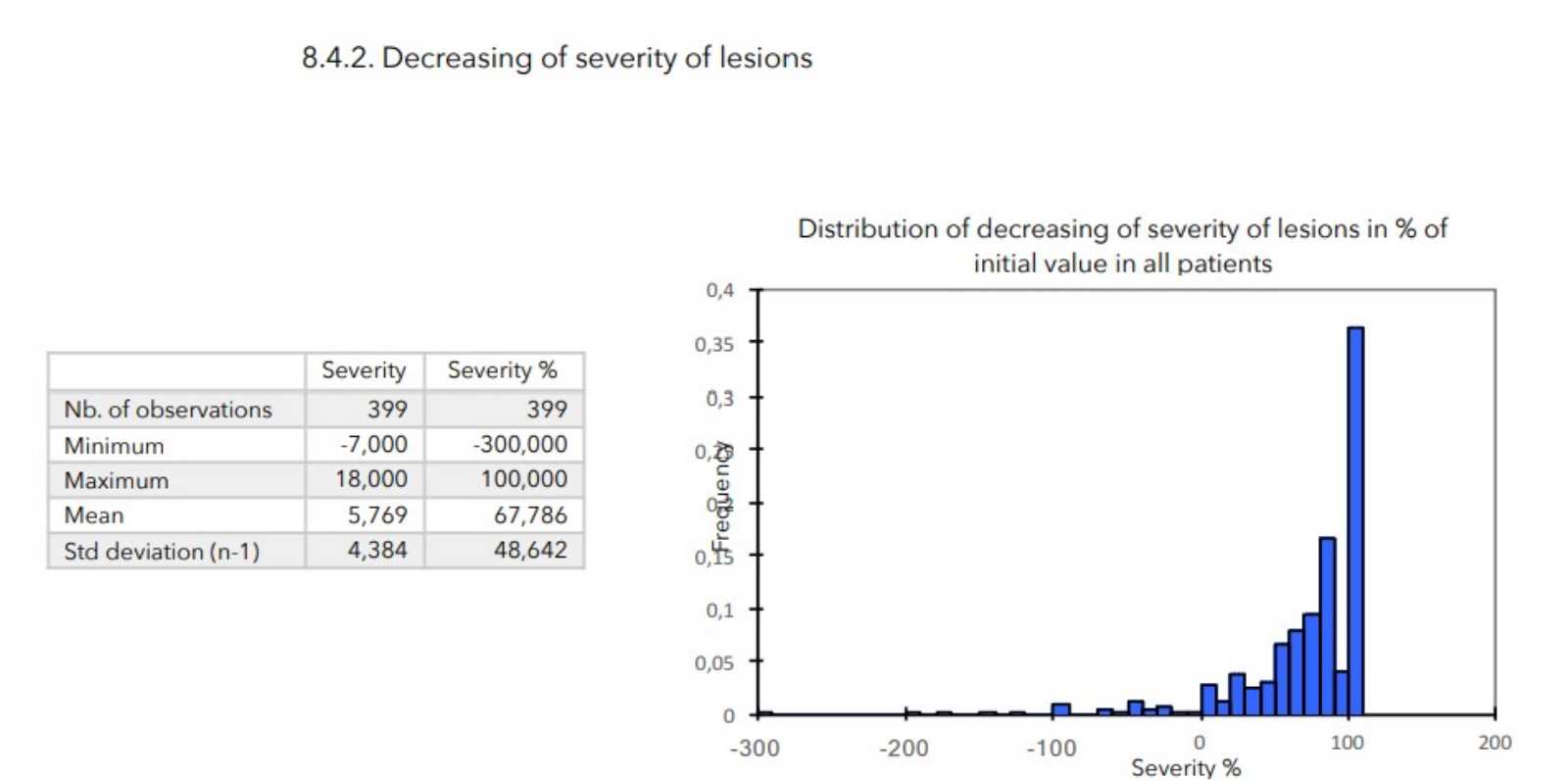
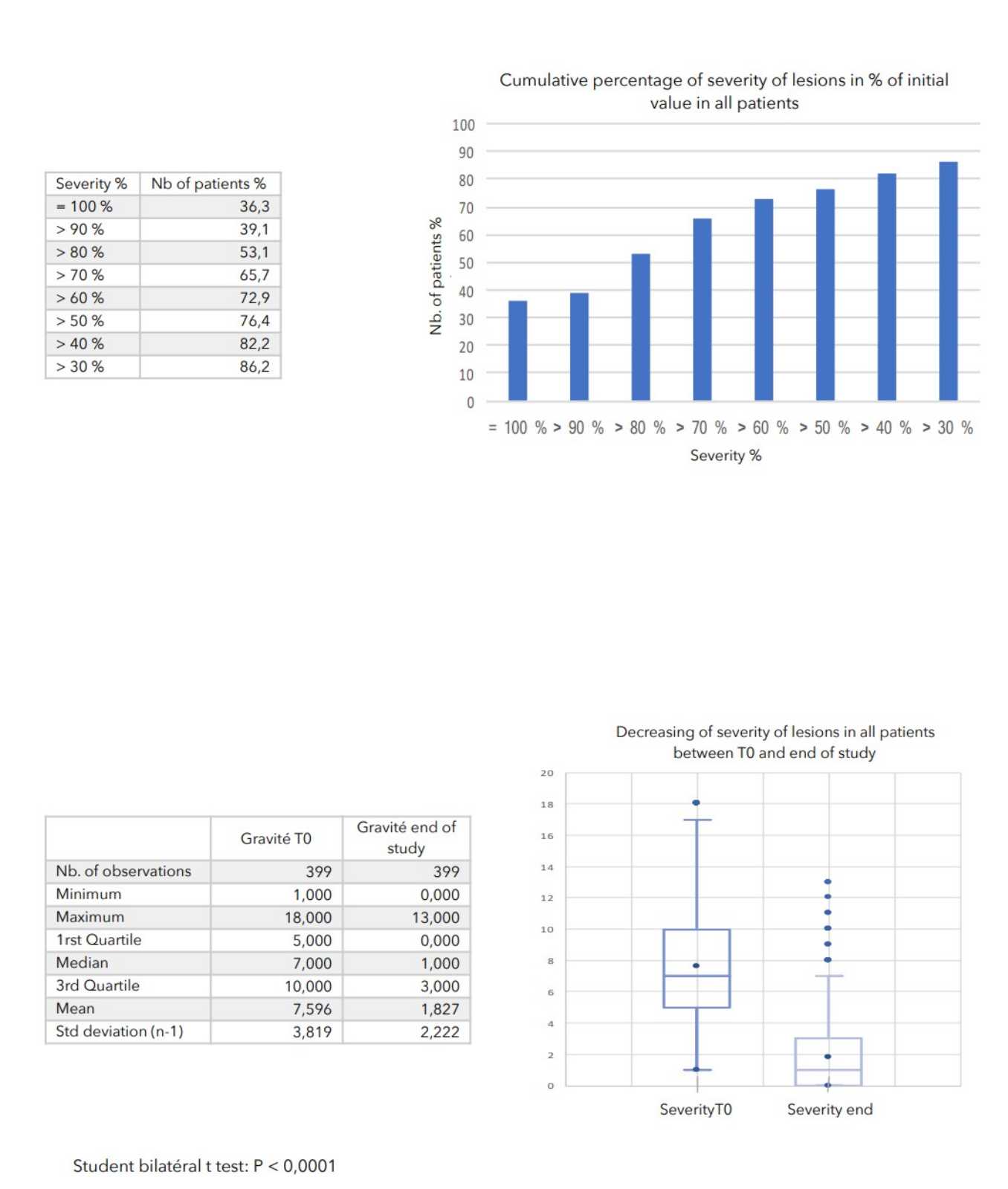
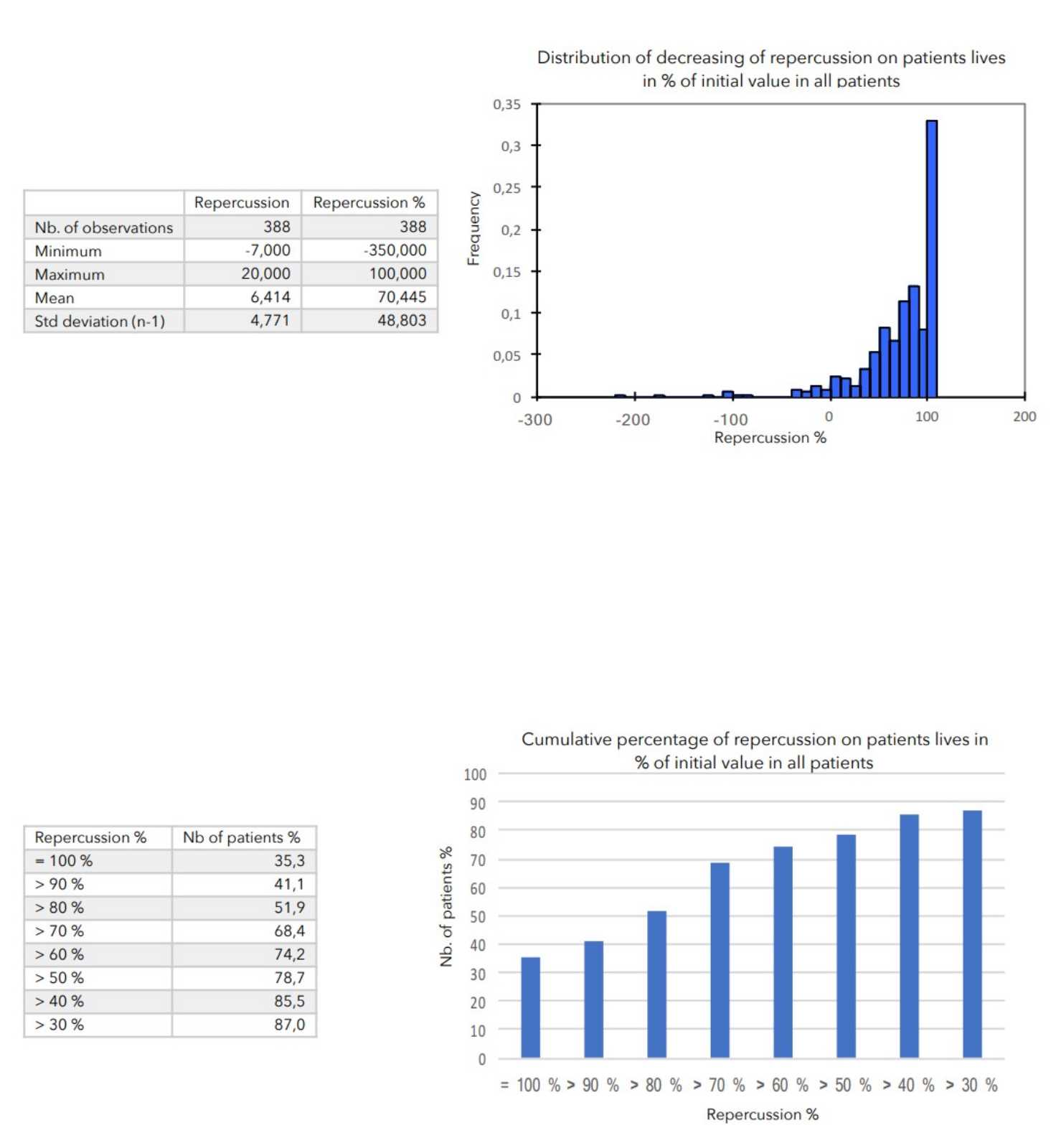
SCHLUSSFOLGERUNGEN:
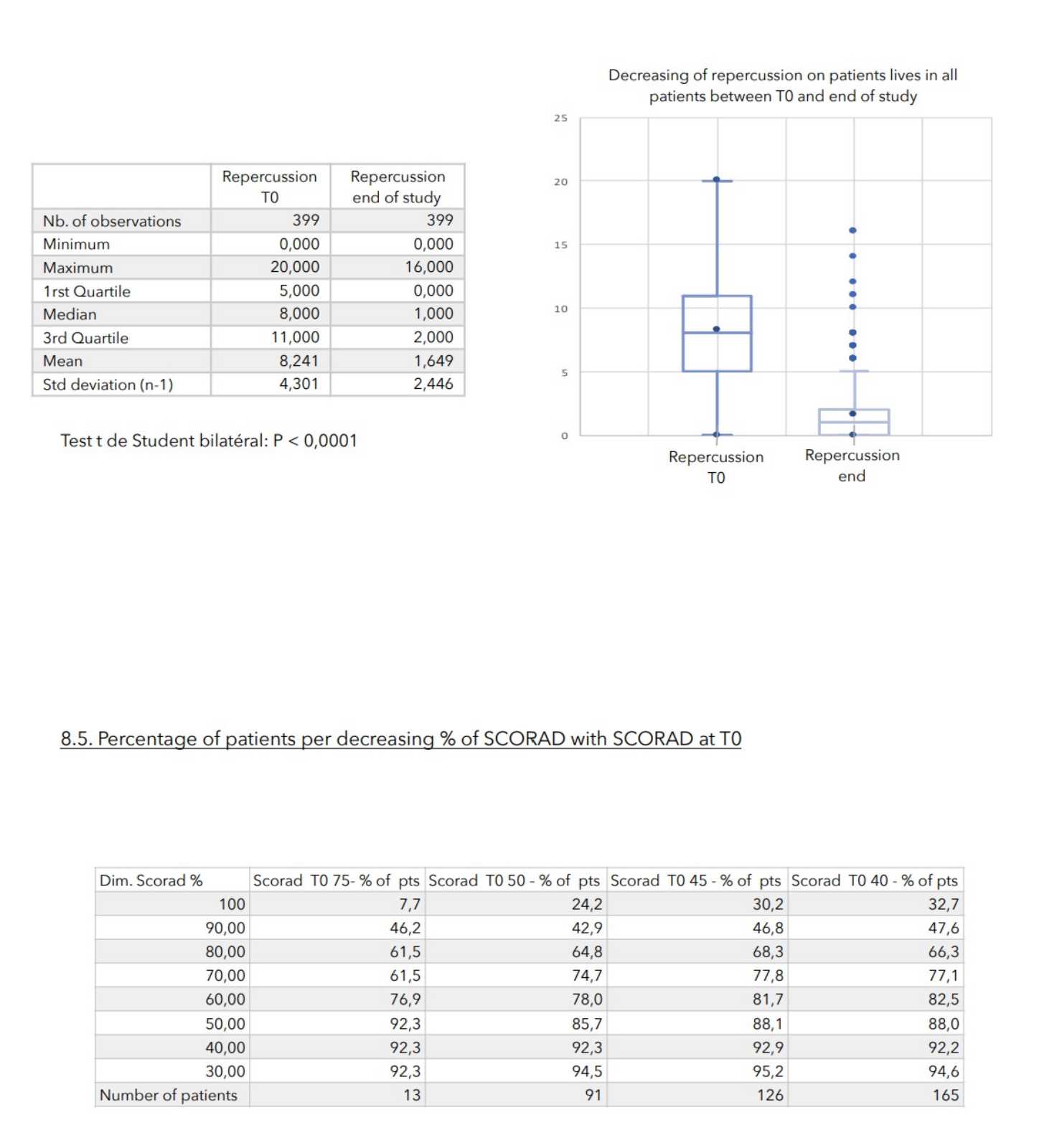
Während der durchschnittlich 4-wöchigen Behandlung wurden bei keinem der 399 in die Studie einbezogenen Patienten nennenswerte Nebenwirkungen festgestellt.
Bei allen zur Beurteilung des Schweregrads der atopischen Dermatitis herangezogenen Parametern war ein starker Rückgang mit hoher statischer Signifikanz zu verzeichnen, wie in der nachstehenden Tabelle zusammengefasst.
